 Espace professionnel | Les fiches culture | La fertilisation | CEC / pH / Conductivité
Espace professionnel | Les fiches culture | La fertilisation | CEC / pH / Conductivité
Les eaux d'arrosage et la fertilisation induisent des résultats différents selon la réactivité du substrat que l'on caractérise par la CEC (Capacité d'Echange Cationique) et le pouvoir fixateur.
Ces conséquences portent notamment sur la résultante du pH et de la conductivité dans le substrat.
- La fertilisation va se raisonner par rapport à la « réactivite » chimique du substrat.
- Un substrat est dit « réactif » quand ce substrat induit une modification de la solution du substrat, c’est-à-dire de la solution dans laquelle les racines s’alimentent.
De par leur constitution naturelle, les matières organiques et les argiles ont une charge électrique négative : ce sont des anions. Les cations, pour leur part, sont des molécules avec une charge électrique positive.
Dans le substrat, les cations sont présents sous deux formes :
En simplifiant, l’adsorption est très semblable à ce qui se passe entre deux aimants :
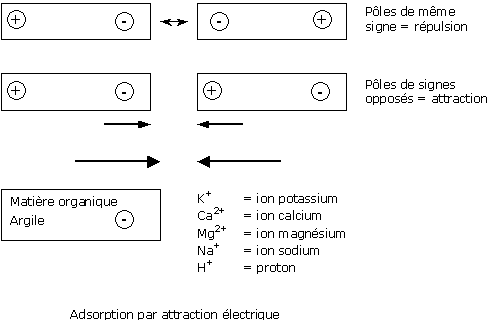
Les forces d’attraction entre les cations adsorbés et la surface des matières organiques ou des argiles sont d’intensité faible. Ces liaisons peuvent donc se rompre facilement.
Grâce à la faiblesse de ces énergies de liaison, il existe donc des échanges permanents entre la solution du substrat et les sites d’adsorption du substrat.
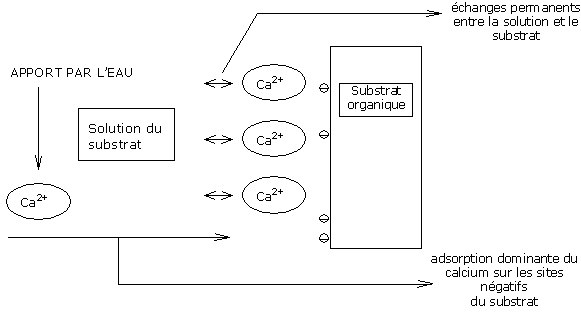
Un apport d’ions calcium dans la solution du substrat induit une adsorption du calcium sur ce même substrat, si des sites de fixation restent disponibles.
Sur un substrat à pH 5,5, la C.E.C. du substrat n’est pas complètement saturée en calcium.
Les ions calcium de l’eau sont alors adsorbés sur les sites négatifs disponibles du substrat, jusqu’à SATURER tous les sites.
On atteint alors le point de saturation de la CEC.
La CEC est certes saturée en calcium, mais est-ce que le pH est pour autant stabilisé ?
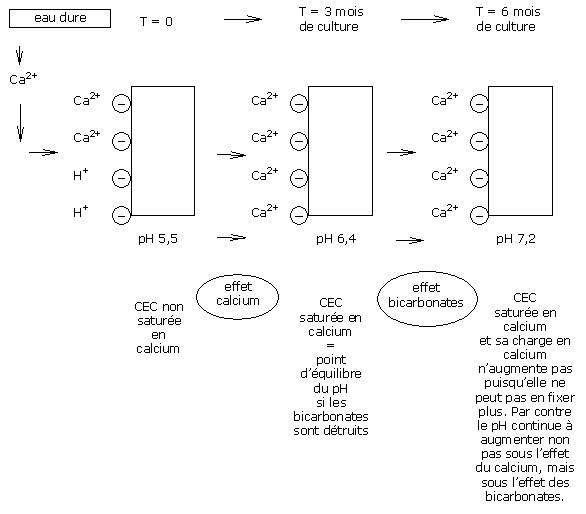
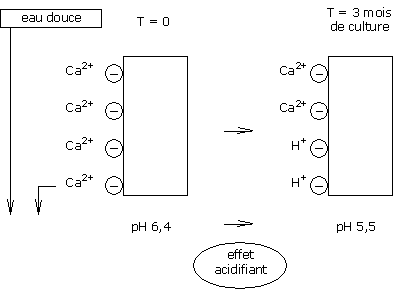
Dans le cas de l’utilisation d’une eau dure sur un substrat « Réactif », le calcium participe donc à la stabilisation du pH de la CEC.
Si les bicarbonates sont détruits, la CEC reste donc en permanence saturée par les ions calcium, ce qui permet donc une bonne stabilisation du pH du substrat.
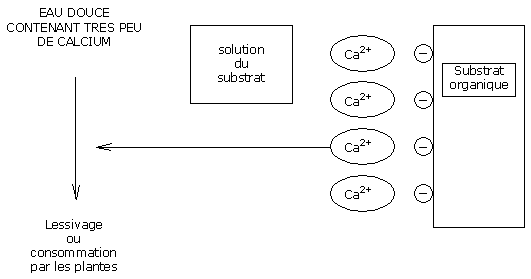
Le calcium fixé sur la CEC des substrats organiques est RESTITUE à la solution du substrat, de façon à toujours maintenir un équilibre identique entre la charge de calcium en solution et la charge de calcium sur le substrat.
Les ions calcium perdus sur la CEC sont remplacés par des ions H+(protons).
Ces ions H+sont acidifiants et induisent une baisse du pH.
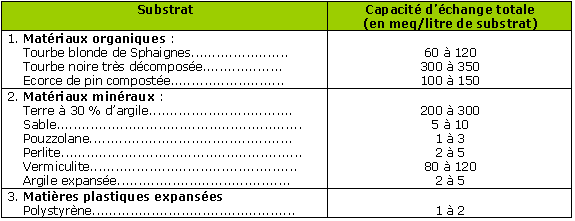
A noter qu’une tourbe noire évoluée est au moins 3 fois plus tamponnée qu’une tourbe blonde.


A noter donc que les quantités fixées sur la CEC sont 40 fois supérieures à celles en solution pour le calcium, et 17 fois supérieures pour le magnésium.
Autant dire que les carences calciques et magnésiennes sur des substrats présentant des pH supérieurs à 5,5 ne sont pas réalistes, de même que sur des substrats faiblement tamponnés, étant donné les fortes réserves de ces deux éléments sur la CEC.
Les « carences », ou dirons-nous les mauvaises assimilations du calcium et du magnésium sur substrats organiques classiques sont « induites » : inadéquation du couple arrosage/substrat le plus souvent.
Exemple du nitrate de calcium apporté sur un substrat à base de tourbe blonde (substrat peu tamponné) :
A pH 5.5, pH jugé faible, un apport de nitrate de calcium est effectué pendant 15 jours, 6 fois à 1 gramme/litre.
Le taux de saturation en calcium de la CEC est proche de 50 %.

Cet exemple montre le côté illusoire d’un redressement rapide du pH avec du nitrate de calcium, quel que soit le substrat organique.
Cas d’un substrat présentant un pH initial de 5.5 ; soit 50 % de saturation en calcium et 25 % de saturation en magnésium.
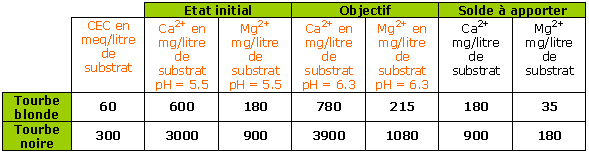
Cas d’une eau dure contenant 80 mg/litre Ca2+ (4 meq/litre Ca2+) et 20 mg/litre Mg2+ (1.7 meq/litre Mg2+) :
Un arrosage moyen de 100 ml/litre de substrat apporte : 8 mg Ca2+et 2 mg Mg2+
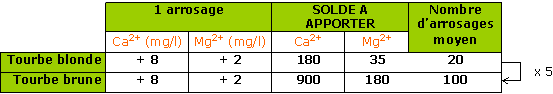
Il faut en moyenne 4 à 5 fois plus d’arrosages avec une eau dure pour faire évoluer le pH d’une unité sur un substrat « noir » par rapport à un substrat « blond ».
Pour des valeurs de pH inférieures à 4.5 et donc pour des CEC dont le taux de saturation est inférieur à 30 % en Ca2+et Mg2+,le risque de carence est réel : bleuissement des azalées, blocage de certaines plantes de terre de bruyère.
En dehors de ces cas extrêmes, et en horticulture en général, on rencontre le plus souvent des carences induites, liées à une mauvaise adéquation du couple substrat / arrosage.
A savoir que le magnésium notamment est d’autant plus mal assimilé que les arrosages sont longs et peu fréquents.
Une insuffisance d’aération racinaire induit également des difficultés d’assimilation du magnésium.
Le calcium est également d'autant plus mal assimilé par les cyclamens que la variété est vigoureuse.
Ces situations de déficience en Ca ou en Mg se corrigent en modifiant la conduite des arrosages, en baissant l'hygrométrie de la serre, en baissant les écarts de température jour/nuit.
Le potassium est un cation dont le pourcentage de fixation sur la CEC est le plus faible (avec l’ammonium), c’est-à-dire que les réserves en potassium ne représentent en moyenne que 2,5 % de la CEC.
De plus, il existe quasiment autant de potassium en solution que de potassium fixé.
Autant dire que le potassium est donc un élément sensible au lessivage.
A noter que le potassium sur un substrat organique se lessive en moyenne deux fois moins vite que l’azote nitrique.
A noter également que l’ion ammonium possède à peu près le même effet « retard » que la potasse (pour laquelle on parle de réserves !).
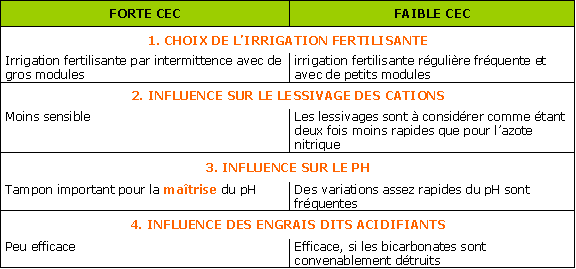
Le pouvoir fixateur d’un substrat correspond à sa capacité à fixer des anions ou des oligoéléments.
Ce pouvoir fixateur est lié à la présence de matières « colloïdales », de type matières organiques ou argiles, ou à la présence d’hydroxydes de fer ou d’alumine.
Le pouvoir fixateur de certains sols pour le phosphore est connu et est lié à la présence de calcaire.
Dans les substrats organiques, les ponts calciques sont peu énergétiques.
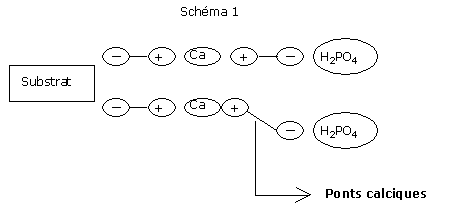
Le pouvoir fixateur du phosphore est plutôt corrélé à la présence de tourbes riches en aluminium ou en fer.
L’énergie de fixation des phosphores sur les tourbes peut être élevée et les phosphates non assimilables pour le cyclamen.
Il est alors nécessaire de saturer l’ensemble des sites aluminiques de phosphates, de façon à ce que tout apport de phosphates par la fertilisation reste assimilable, et donc soluble à l’eau.
C'est le rôle de la fertilisation de fond.
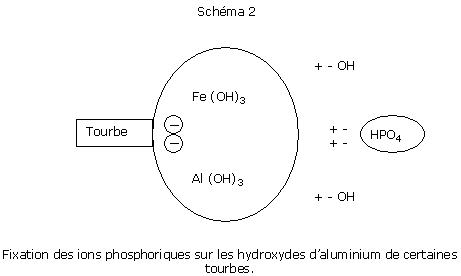
Cl-: les chlorures et l’azote nitrique sont parfaitement lessivables.
SO42-: les sulfates sont également lessivables mais présentent la caractéristique de précipiter sous forme de microcristaux de gypse (CaSO4, 2H2O). Ces microcristaux s’accumulent et abaissent pendant un certain temps la concentration en sulfates du milieu. En fin de culture longue, la précipitation sous forme de gypse est ralentie et le taux de sulfates peut augmenter si l’effet « chasse d’eau » n’est pas suffisant.
A noter néanmoins que les engrais sulfatés sont plus salants que leurs équivalents nitrates ou phosphates, d'où la nécessité de sélectionner des engrais peu chargés en sulfate afin de limiter la salinité "immédiate".
BO33-: le bore est adsorbé sur le complexe organique. Son passage en solution aqueuse est rapide. Son assimilabilité est d'autant plus mauvaise que l'alternance arrosages abondants/stress hydrique est importante. Ce phénomène est classique en été.
MoO42-: le molybdène est considéré comme non lessivable sauf à pH acide.
Les oligoéléments précédents sont présents dans les substrats organiques essentiellement sous forme chélatée : les chélates protègent les oligoéléments du lessivage.
Les oligoéléments sont peu solubles à l’eau.
L’essentiel de l’assimilation s’effectue par contact entre la racine et le substrat. Si le contact est insuffisant, l’assimilation n’a pas lieu et les risques de carence sont accrus.
A retenir également la fixation très forte du cuivre par les matériaux fermentescibles induisant de graves malformations.
Toutes les réactions biochimiques, que ce soit chez l’homme, l’animal, ou le végétal, sont conditionnées par le milieu dans lequel elles ont lieu.
Un des principaux facteurs qui conditionnent le bon fonctionnement de la vie est le pH du milieu.
La sève des cyclamens, elle-même, possède un pH spécifique à l’espèce.
Le pH est un élément fondamental pour la maîtrise de la nutrition, puisqu’il détermine les conditions d’assimilation des éléments minéraux.
Le pH mesure une concentration en ions hydrogène, H+, d’où son nom de Potentiel Hydrogène.
Il permet de mesurer l’acidité ou l’alcalinité du milieu.
pH = - log [H3O+]

Les rapports les plus fréquemment utilisés sont : 1/1.5 ; 1/2.5 ; la future méthode européenne prévoit un rapport 1/5.
Le pH est très sensible au taux d’oxygénation de l’extrait : plus l’extrait est saturé en CO2(gaz carbonique), plus la valeur du pH eau s’élève.
Plus la salinité du substrat est élevée et plus la valeur du pH eau s’abaisse.
L’écart entre le pH eau et le pH KCl est alors très faible. En effet, la présence de sels, d’engrais qui sont des acides faibles ou des bases faibles tamponne le comportement de l’hydrogène.

Le pH eau reste le pH qui reflète le mieux les conditions réelles de pH présentes au niveau des racines.
C’est donc cette mesure qui sera utilisée par le producteur pour suivre sa fertilisation.
Les pH obtenus avec cette méthode sont toujours intermédiaires entre pH H2O et pH KCl.
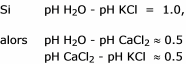
Cette méthode, inspirée des sols, consiste à réaliser un extrait 1/2.5 avec une solution KCl 1 N.
Ce pH indique l’état de saturation de la CEC et est assez indépendant des conditions du milieu.
Ce pH permet donc de bien visualiser l’évolution de la saturation ou de la désaturation en Ca et Mg du substrat.
Exemple :
Mesure à un instant T de la culture :
15 jours après, la conductivité baisse, suite à des arrosages appropriés :
Le pH KCl traduit toujours un niveau élevé de saturation de la CEC et ce pH eau reprend une valeur plus cohérente de 6.9 qui devient une valeur à risque pour la culture.
La mauvaise maîtrise du pH est un facteur régulier d’accidents sur cyclamens.

L’intoxication en aluminium, voire en manganèse est à corréler à la présence de pH acide en présence de matériaux instables et fermentescibles.
Les fermentations augmentent la réduction du manganèse et de l’aluminium, formes qui deviennent alors solubles et potentiellement toxiques. Le phénomène est alors aggravé par l’asphyxie racinaire (manque d’oxygène lié aux fermentations).
Ce phénomène d’intoxication est fréquent quand les pH baissent en culture et que la conductivité augmente.
La carence en molybdène à pH acide est plus rare.
A pH élevé, la mauvaise disponibilité du phosphore est peu remarquée et se traduit plutôt par un mauvais rendement des plants.
A pH élevé, dès l’approche de niveaux de pH de 7.1 à 7.2, la carence en bore est bien réelle.
Elle est très souvent observée en été. En effet, non seulement le bore est peu disponible à ces niveaux de pH, mais en plus le régime hydrique global est souvent insuffisant, ce qui inhibe l’assimilation du bore, fréquent sur cyclamens.
A pH élevé, la carence en fer et en manganèse est classique sur les espèces sensibles à la chlorose ferrique, dont le cyclamen bien sûr, qui, en tant qu'espèce à bulbe, assimile mal ces deux éléments.
Attention ! Ce n’est pas en mesurant le pH d’une eau que l’on peut définir la « dureté » de l’eau, et donc son effet sur le substrat.
Exemple: l’eau de pluie
L’eau de pluie ne contient aucun bicarbonate.
Elle n’est donc pas tamponnée.
Cette eau prend alors la valeur du pH du milieu dans lequel elle évolue.
Stockée en bassin, son pH est souvent proche de 8.0 ! .... En effet, son pH est alors fonction de la charge en gaz solubilisés dans l’eau (CO2notamment).
Cette même eau de pluie issue du bassin à pH 8.0, apportée sur un substrat à pH 5.8 prend cette valeur de pH et induit progressivement une décalcification du substrat, et donc une acidification.
La « dureté » d’une eau d’arrosage est fonction du taux de bicarbonates : HCO3- et non de son pH.
Les bicarbonates sont une base forte (l’inverse d’un acide fort) car ils induisent une forte hausse du pH.
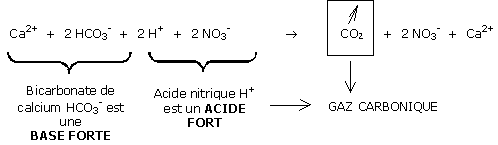
A noter que les bicarbonates disparaissent sous forme de gaz carbonique et que reste en équilibre un couple acide faible/base faible : NO3-/Ca2+ en solution.
Le pH ne peut donc plus augmenter.
Il est stable puisque le calcium de l’eau toujours présent compense les pertes de Ca2+ sur la CEC.
Une eau douce ne contient pas de bicarbonates.
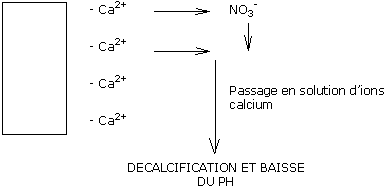
Une complémentation au nitrate de calcium est alors nécessaire pour compenser les pertes de calcium et donc stabiliser le pH.
L’essentiel des caractéristiques acidifiantes des engrais provient des fractions ammoniacales.
Les engrais contenant de l’urée et certains engrais à libération lente (non conseillés sur cyclamen), contenant des polymères d’urée sont acidifiants puisque l’urée se transforme en azote ammoniacal par hydrolyse.
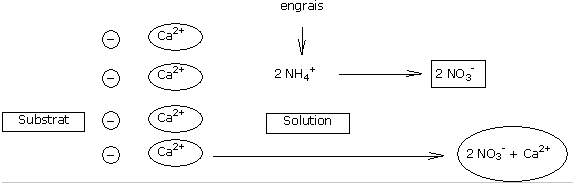
La transformation de l’azote ammoniacal en azote nitrique en solution aqueuse induit le passage en solution d’un cation Ca2+ (ou Mg2+) fixé sur la CEC pour équilibrer électriquement la solution.
Ce passage en solution des ions calcium et magnésium favorise l’acidification progressive du milieu.
Certains engrais intègrent des acides forts afin de détruire une fraction des bicarbonates présents.
pH et stabilité biologique des matériaux organiques présents
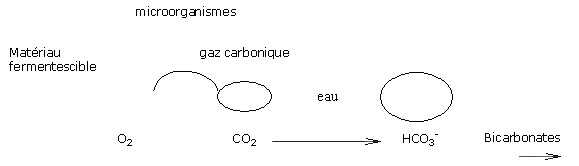
La fermentation de matériaux de type écorces fraîches, composts, ... induit la fabrication de gaz carbonique dans la solution du substrat.
Une pression forte en gaz carbonique dans l’eau favorise la formation de bicarbonates et donc la hausse de pH.
Au terme de 6 mois de culture, un mélange à base d’écorces démarrant à un pH de 5.8 peut atteindre des pH supérieurs à 7.2 en fin de culture.
La salinité, exprimée en grammes par litre, exprime la quantité de sels dans la solution du substrat.
Elle est mesurée à l’aide de la conductivité électrique.
Le principe de la mesure repose sur la propriété qu’ont les électrolytes (substances dissociées en ions après dissolution) de conduire le courant électrique d’autant plus facilement que leur concentration est élevée.
Il existe deux modes d’expression :
1.- Conductivité, exprimée en millisiemens par centimètre (mS/cm)
Elle est proportionnelle à la salinité.
2.- Résistivité, exprimée en ohm-cm
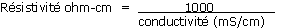
La mesure de conductivité est couramment effectuée en France sur un extrait 1/1.5 volumique :
1 volume de substrat pour 1.5 volume d’eau déminéralisée.
La mesure s’effectue après 20 minutes de contact minimum, avec filtration recommandée.
L’effet le plus immédiat de la salinité de la solution du substrat est de créer une pression osmotique telle que le cyclamen ne peut plus absorber d’eau.
C’est ce que l’on appelle la sécheresse physiologique.
Ce procédé est utilisé pour la maîtrise de la vigueur.
La vigueur d'une plante à bulbe est surtout fonction de la "régularité" des facteurs de production. Plus les arrosages sont réguliers et la conductivité constante, meilleurs sont la vigueur et l'équilibre végétatif.
Sur cyclamen en potée fleurie traditionnelle, la conductivité sera plutôt basse.
Sur mini-cyclamen et sur substrats à dominante tourbeuse (donc à faible coefficient de salinité réel), les conductivités seront élevées afin de maintenir un port de plante compact. En effet, le rythme des arrosages sur de faibles volumes de substrat favorise un confort hydrique qui doit être jugulé par des conductivités plus élevées.
La mesure de conductivité peut être utilisée pour appréhender le niveau nutritif du substrat.
Exemple 1 :
Extraction 1/1.5 vol. Mesure de la conductivité et des éléments nutritifs sur un substrat tourbeux enrichi en PG Mix : à 1 kg/m3


Dans cet exemple, la mesure de conductivité peut sous-estimer la fraction azotée.
Effectivement, l’azote ammoniacal se nitrifie et la conductivité augmente schématiquement d’autant.
Exemple 2 :
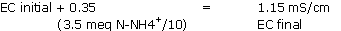

Le niveau de conductivité mesuré indique à priori un niveau nutritif convenable, alors que la conductivité n’est corrélée qu’à une charge élevée en sulfates (les matériaux organiques fabriquent des sulfates lors de leur maturation).
Il est alors préférable sur cet extrait d’effectuer une mesure d’azote, avec des tests rapides par exemple.
Attention à l’excès de sel qui conduit à des sensibilisations aux maladies, à l’altération des poils adsorbants et à la mauvaise migration du calcium et du magnésium notamment.
2565, rue de Montourey
83600 Fréjus - France
Téléphone international : +33 (0)4 94 19 73 04
Standard : + 33 (0)4 94 19 73 00
Fax : +33 (0)4 94 19 73 19

