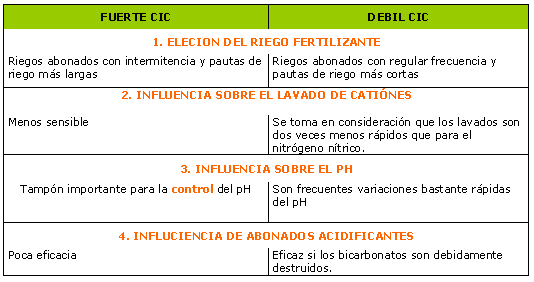
 Espacio profesional | Cultivo | El abonado | CIC / pH / Conductividad
Espacio profesional | Cultivo | El abonado | CIC / pH / Conductividad
Las aguas de riego y la fertilización inducen a unos resultados distintos según la reacción del substrato que esta caracterizado por la CIC (Capacidad de Intercambio Catiónico) y el poder fijador.
Estas consecuencias llevan a resultados de diferentes valores de pH y de conductividad eléctrica en el substrato.
De su constitución natural, las materias orgánicas y las arcillas tienen una carga eléctrica negativa: estos son los aniónes. Los catiónes, por su parte, son moléculas con una carga eléctrica positiva.
En los substratos, los catiónes están presentes bajo dos formas:
Simplificando, la adsorción es muy parecida a la que ocurre entre dos amantes:
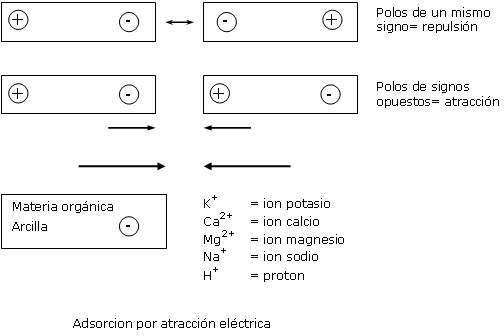
Las fuerzas de atracción entre los catiónes adsorbidos y la superficie de materias orgánicas o de arcillas son de baja intensidad. Estas soldaduras pueden romperse fácilmente.
Gracias a esta debilidad de energías de contacto, existen por lo tanto intercambios permanentes entre la solución del substrato y el punto de adsorción del substrato.
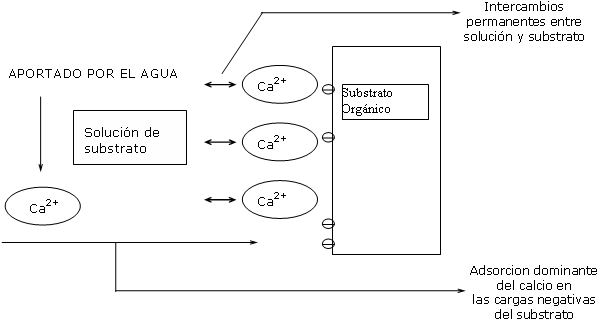
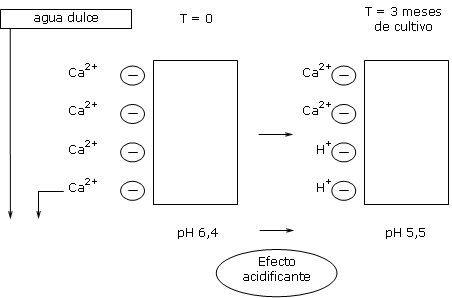
Un aporte de iones calcio en la solución del substrato induce a una adsorción de calcio sobre el mismo substrato, si las plazas de fijación quedan disponibles.
En un substrato a pH 5,5, la CIC del substrato no esta completamente saturada de calcio.
Los iones calcio del agua son por lo tanto adsorbidos sobre las plazas negativas disponibles del substrato, hasta SATURAR todas las plazas.
Se consigue por lo tanto un punto de saturación de la CIC.
¿La CIC esta por lo tanto saturada en calcio, pero solo el pH esta por lo tanto estabilizado?
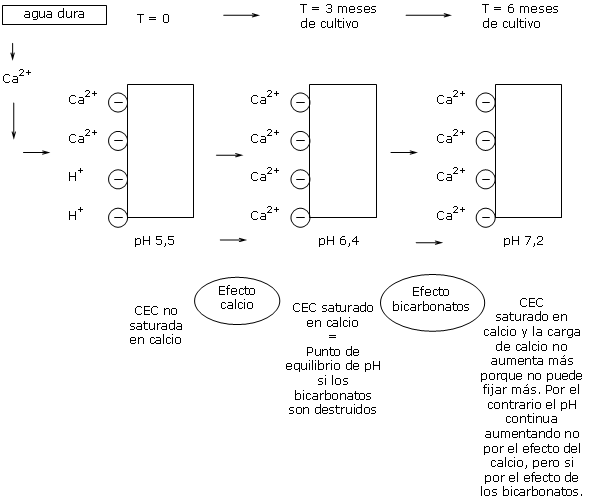
En el caso de utilizar un agua dura sobre un sustrato « Reactivo » el calcio participa en la estabilidad del pH de la CIC.
Si los bicarbonatos son destruidos, la CIC queda por lo tanto en permanente saturación por los iones de calcio, lo que permite una buena estabilidad del pH en el substrato.
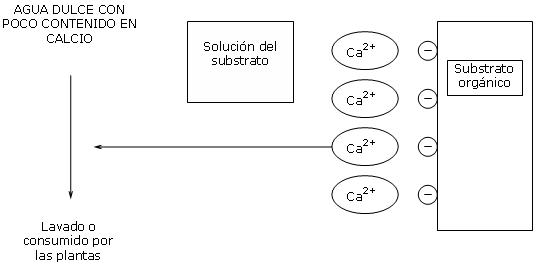
El calcio fijado sobre la CIC de los substratos orgánicos es RESTITUIDO a la solución del substrato, de manera que siempre se mantiene un equilibrio idéntico entre la carga de calcio en solución y la carga de calcio en el substrato.
Los iones de calcio perdidos sobre la CIC son sustituidos por los iones H+ (protones).
Estos iones H+ son acidificantes y inducen a descender el pH.

Anotar que una turba negra es 3 veces más tamponada que una turba rubia.

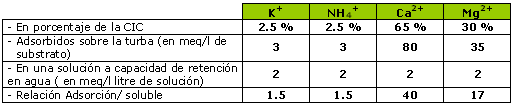
Anotar pues que las cantidades fijadas sobre la CIC son 40 veces superiores a las que hay en solución en el caso del calcio, y 17 veces superiores para el magnesio.
Las carencias de calcio y magnesio en substratos que presentan un pH superior a 5,5 no son reales, lo mismo para substratos débilmente tamponados, dadas las fuertes reservas de estos elementos sobre la CIC.
Las « carencias », o digamos malas asimilaciones del calcio y del magnesio en substratos orgánicos clásicos son “inducidas”: lo más a menudo es una inadecuada relación de la pareja riego/substrato.
Ejemplo de nitrato de calcio aportado sobre un substrato a base de turba rubia (substrato poco tamponado) :
A ph 5.5, pH débil, un aporte de nitrato de calcio se efectúa durante 15 días, 6 veces a 1 gramo/litro.
La tasa de saturación en calcio de la CIC es próxima al 50%.

Este ejemplo muestra el lado ilusorio de una recuperación rápida del pH con el nitrato calcico, sea cual sea el substrato orgánico.
Caso de un substrato presentando un pH inicial de 5,5; siendo un 50% de saturación del calcio y 25% de saturación del magnesio.
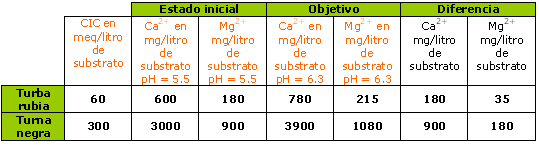
Caso de un agua dura que contiene 80 mg/l Ca2+ (4 meq/l Ca2+) y 20 mg/l Mg2+ (1,7 me/l Mg2+).
Un riego medio de 100 ml/ litre de substrato aporta: 8 mg Ca2+ y 2 mg Mg2+.
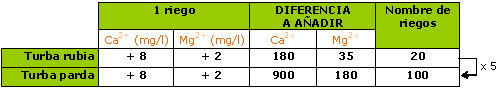
Es necesario una media de 4 a 5 veces más de riegos con un agua dura para hacer subir el pH en un substrato con turba “negra” que con turba “rubia”.
Para valores de pH inferiores a 4,5 y de la CIC cuya tasa de saturación es inferior al 30% en el Ca2+ y Mg2+, el riesgo de carencia es real: azulamiento de azaleas, bloqueo de ciertas plantas de tierra de brezo.
A parte de estos casos extremos, y en horticultura en general, se encuentran más a menudo carencias inducidas, ligadas a una mala adecuación de la interacción del substrato y el riego.
Es importante saber que el magnesio es de mala asimilación cuando los riegos son largos y poco frecuentes.
Una insuficiencia de aireación radicular induce igualmente a las dificultades de asimilación del magnesio.
El calcio es igualmente de mala asimilación cuanto más vigorosa es la variedad.
Estas situaciones de deficiencia en Ca o en Mg se corrigen modificando la conducta de los riegos, bajando la higrometría del invernadero, bajando las diferencias de temperatura día/noche.
El potasio es un catión cuyo porcentaje de fijación sobre la CIC es el más débil (como el amonio), es decir que las reservas en potasio representan un media de solo 2,5% de la CIC.
Además existe casi más potasio en solución que potasio fijado. En conclusión que el potasio es un elemento sensible al lavado.
Anotar que el potasio sobre substrato orgánico se lava una media de dos veces menos que el nitrógeno nítrico.
Anotar igualmente que el ion amonio posee aproximadamente el mismo efecto “retardado” que el potasio (por el que se habla de reservas).
El poder fijador de un substrato corresponde a su capacidad de fijar los aniónes o los oligoelementos.
Este poder fijador esta relacionado con la presencia de materias “coloidales”, tipo materias orgánicas o arcillosas, o la presencia de hidróxidos de hierro o de aluminio.
El poder fijador de ciertos suelos para el fósforo es conocido y esta relacionado a la presencia del calcio.
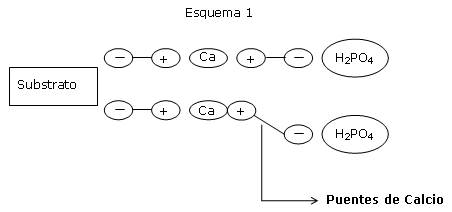
En los substratos orgánicos, los puentes de calcio son poco energéticos.
El poder fijador del fósforo es más bien relacionado a la presencia de turbas ricas en aluminio o en hierro.
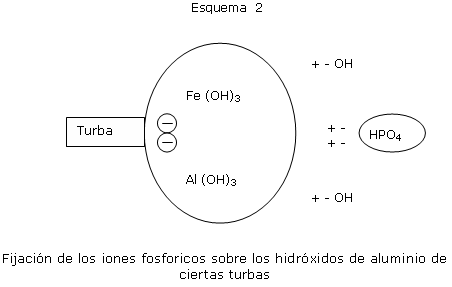
La energía de fijación de los fósforos sobre las turbas puede ser elevada a los fosfatos no asimilables por el ciclamen.
Es entonces necesario saturar el conjunto donde se ubican los fosfatos de aluminio, de manera que todo el aporte de los fosfatos por la fertilización queda asimilable, y por lo tanto soluble en agua.
Esta es la función del abonado de fondo.
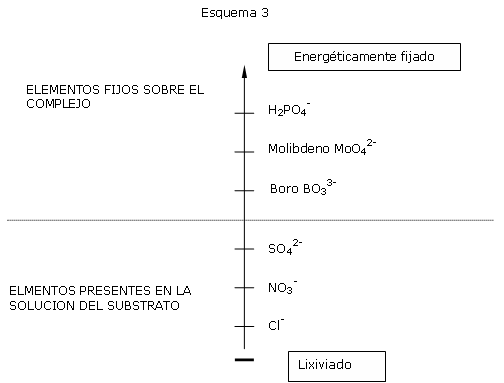
Cl-: Los cloruros y el nitrógeno nítrico son perfectamente lixiviables.
SO42- : Los sulfatos son igualmente lixiviables pero presentan la característica de precipitar bajo forma de microcristales de gypso (CaSO4, 2H2O). Estos microcristales se acumulan y bajan durante un cierto tiempo la concentración en sulfatos en el medio. Al final de cultivos largos, la precipitación bajo forma de cristales gypso es más lenta y la tasa de sulfatos puede aumentar si el efecto “caza de agua” no es suficiente.
Anotar que los abonos sulfatados son más salados (alta conductividad) que sus equivalentes nitratos y fosfatos. De ahí la importancia de buscar una abono poco cargado en sulfatos con el fin de limitar la salinidad “inmediata”.
BO3 3-: El boro es adsorbido sobre el complejo orgánico. Su paso a solución acuosa es rápido. Su capacidad de asimilación puede empeorar con riegos abundantes combinados con situaciones de estrés hídrico. Este fenómeno es muy clásico en verano.
MoO42-: El molibdeno es considerado como no lixiviable menos en pH acido.
Los oligoelementos precedentes son presentes en los substratos orgánicos esencialmente bajo forma quelatada: los quelatos protegen los oligoelementos de la lixiviación.
Los oligoelementos son poco solubles en agua.
Lo esencial de la asimilación se efectúa por contacto entre las raíces y el substrato. Si el contacto es insuficiente, la asimilación no tiene lugar y el riesgo de carencias incrementa.
Retener también la fijación muy fuerte de cobre por los materiales fermentables que pueden inducir a fototoxicidad por males malformaciones.
Todas las reacciones bioquímicas, sean en el hombre, animal, o de vegetales, son condicionadas por el medio en el cual tienen lugar.
Uno de los principales factores que condicionan el buen funcionamiento de la vida es el pH del medio.
La propia savia de los ciclámenes, posee un pH específico de la especie.
El pH es un elemento fundamental para la regulación de la nutrición, este determina las condiciones de asimilación de los elementos minerales.
El pH mide una concentración de iones hidrogeno, H+, de ahí su nombre de Potencial de Hidrogeno.
Permite medir la acidez o alcalinidad del medio.
pH = - log [H3O+]

Los informes utilizados más frecuentemente son: 1/1.5; 1/2.5; el futuro método europeo previsto sea una relación 1/5.
El pH es muy sensible a la tasa de oxigenación del extracto: cuanto más saturado esta de CO2 (gas carbónico), más elevado puede ser el pH del agua.
Cuanto más elevada sea la salinidad del substrato más puede bajar el valor del pH del agua.
La diferencia entre el pH del agua y el pH KCl es muy poca. En efecto, la presencia de sales, abonos de baja acidez y alcalinidad tamponan el comportamiento del hidrogeno.
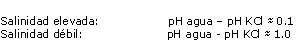
El pH del agua es el pH que refleja la mejor de las condiciones reales de pH presentes a nivel de las raíces.
Es pues esta medida la que será utilizada por el productor para seguir su abonado.
Los pH obtenidos con este método son siempre intermediarios entre pH H2O y pH KCl.
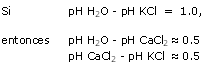
Este método, inspirado en suelos, consiste en realizar una extracción 1/2.5 con una solución, KCl 1 N.
Este pH indica el estado de saturación de la CIC y es bastante independiente de las condiciones del medio.
Este permite por lo tanto visualizar la evolución de la saturación o de la desaturación del
Calcio y el Magnesio del substrato.
Ejemplo:
Medida en un instante T del cultivo:
15 días después, la conductividad baja, seguido de riegos apropiados:
El pH KCl traduce siempre el nivel de saturación de la CIC y el pH del agua toma un valor más coherente de 6.9 que puede llegar a ser un valor de riesgo para el cultivo.
La mala conducción del pH es un factor regular de los accidentes sobre ciclamen.

La intoxicación en aluminio, como en el manganeso esta relacionada a la presencia de pH acido en presencia de materiales inestables y fermentables.
Las fermentaciones aumentan la reducción del manganeso y del aluminio, formas que llegan ser solubles y potencialmente toxicas. El fenómeno es entonces agravado por la asfixia radicular (falta de oxigeno ligado a las fermentaciones).
Este fenómeno de intoxicación es frecuente cuando el pH baja en cultivo y la conductividad aumenta.
La carencia de molibdeno con pH acido es poco frecuente.
A pH elevado, la mala disponibilidad del fósforo es poco remarcada, más bien se traduce en un mal rendimiento de la planta.
A pH elevado, a niveles aproximados de pH de 7,1 a 7,2, la carencia en boro es real.
Esta más a menudo observada en verano. En efecto no solo el boro es poco disponible es estos niveles de pH, además el régimen hídrico global es a menudo insuficiente, lo que inhibe la asimilación de boro, frecuente en ciclámenes.
A pH elevado, la carencia de hierro y manganeso es clásica sobre especies sensibles a la clorosis ferrica, el ciclamen por ejemplo, que, como especie con bulbo, asimila mal estos elementos.
Atención! No es midiendo el pH del agua lo que podremos definir como la “dureza” del agua, y por lo tanto su efecto sobre el substrato.
Ejemplo: Agua de lluvia
El agua de lluvia no contiene ningún bicarbonato.
Por lo tanto no es un agua tamponada.
Esta agua toma entonces el valor de pH del medio en la cual evoluciona.
Almacenada en depósitos, el ph es a menudo próximo a 8,0! … En efecto, su pH es entonces en función de la carga del gas soluble en el agua (CO2 mayormente).
Esta misma agua de lluvia procedente del deposito a pH 8.0, aportado sobre un substrato a pH 5,8 toma este valor de pH e induce progresivamente a una descalcificación del substrato y por lo tanto una acidificación.
La “dureza” de un agua de riego es en función de la tasa de bicarbonatos: HCO3- y no de su pH.
Los bicarbonatos son una base fuerte (inverso a un acido fuerte) pues estos inducen a una fuerte subida de pH.
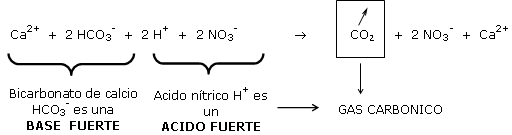
Anotar que los bicarbonatos desaparecen bajo forma de gas carbónico y que queda en equilibrio un pareja de acido débil/base débil: NO3-/Ca2+ en solución.
El ph no puede aumentar.
Este es estable pues el calcio del agua siempre presente, compensa las perdidas de Ca2+ sobre la CIC.
Un agua dulce no contiene bicarbonatos.
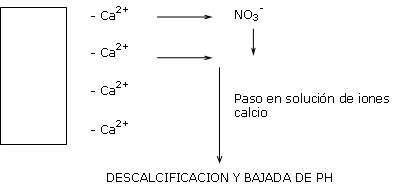
Una complementación al nitrato de calcio es entonces necesaria para compensar las perdidas de calcio y estabilizar el pH.
La fracción más acidificante de todos los abonos corresponde a la fracción amoniacal.
Los abonos que contienen urea y ciertos abonos de liberación lenta (no aconsejados para el ciclamen), contienen polímeros de urea que son acidificantes porque se convierten en nitrógeno amoniacal por hidrólisis.
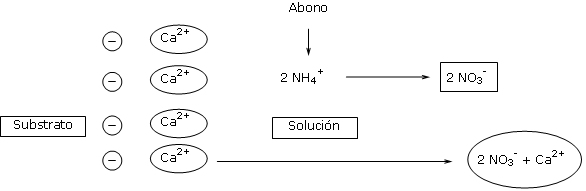
La transformación de nitrógeno amoniacal en nitrógeno nítrico en solución acuosa induce el paso en solución de un catión Ca2+ (o Mg2+) fijado sobre la CIC para equilibrar eléctricamente la solución.
Este paso en solución de los iones calcio y magnesio favorece la acidificación progresiva del medio.
Ciertos abonos integran ácidos fuertes con el fin de destruir una fracción de bicarbonatos
presentes.
pH y estabilidad biológica de las materias orgánicas presentes.
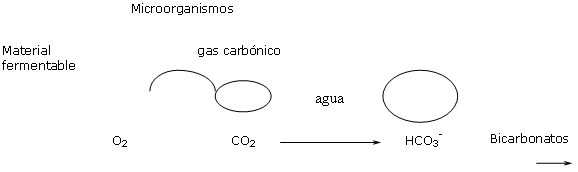
La fermentación de materiales de tipo cortezas frescas, compost,… induce la fabricación de gas carbónico en la solución del substrato.
Una presión fuerte del gas carbónico en el agua favorece la formación de bicarbonatos y por tanto una subida de pH.
Al final de los 6 meses de cultivo, una mezcla a base de cortezas devine a un pH de 5.8 puede conseguir pH superiores a 7.2 a final de cultivo.
La salinidad, expresada en gramos por litro, expresa la cantidad de sales en la solución del substrato.
Esta es medida en forma de conductividad eléctrica.
El principio de la medida se basa sobre la propiedad que tiene la electrolisis (substancias disociadas en iones después de la disolución) de conducir una corriente eléctrica tanto más cuanto más concentrada.
Existen dos medios de expresión:
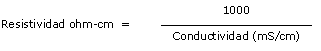
La medida de conductividad es a menudo efectuada en Europa sobre un extracto 1/1.5 en volumen:
1 volumen de substrato por 1.5 volumen de agua desmineralizada.
La medida se efectúa después de 20 minutos de contacto mínimo, con filtración recomendada.
El efecto más inmediato de la salinidad de la solución del substrato es crear una presión
osmótica tal que el ciclamen no pueda absorber más agua.
Esto es lo que llamamos sequedad fisiológica.
Este procedimiento es utilizado para el control del vigor.
El vigor de una planta de bulbo es sobretodo función de la “regularidad” de los factores de producción. Cuando más regulares son los riegos y más constante es la conductividad, mejores son el vigor y el equilibrio vegetativo.
Para ciclamen en flor y cultivo tradicional, la conductividad será más bien baja.
Para ciclamen mini y sobre substratos con predominio de turbas (débil coeficiente de salinidad real), las conductividades serán elevadas con el fin de mantener un porte de planta compacta. El ritmo de riegos sobre débiles volúmenes de substratos favorece un confort hídrico que debe ser controlado por conductividades más elevadas.
La medida de la conductividad puede ser utilizada para retener el nivel nutritivo del substrato.
Ejemplo 1 :
Extracción 1/1.5 vol. Medida de la conductividad y de los elementos nutritivos sobre un substrato turboso enriquecido en PG Mix 1kg/m3.
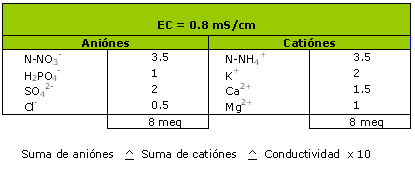
En este ejemplo, con la medida de conductividad puede sobre estimarse la fracción nitrogenada.
En efecto, el nitrógeno amoniacal se nitrifica y la conductividad aumenta de manera esquemática.
Ejemplo 2:
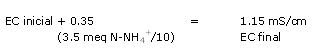
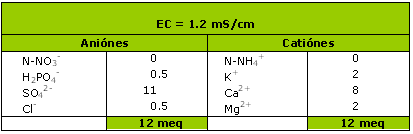
El nivel de conductividad medida indica un nivel nutricional aceptable, por lo tanto la conductividad esta ligada directamente a una carga elevada de sulfatos (los materiales orgánicos fabrican sulfatos durante su maduración).
Es entonces conveniente sobre esta muestra efectuar una medida de nitrógeno con los test rápidos por ejemplo.
Atención al exceso de sal que conduce a las sensibilidades de las enfermedades, alteración de los pelos adsorbentes y a la mala migración del calcio y del magnesio.
2565, rue de Montourey
83600 Fréjus - France
Teléfono internacional : +33 (0)4 94 19 73 04
Estándar : + 33 (0)4 94 19 73 00
Fax : +33 (0)4 94 19 73 19

