 Area professionisti | Le schede coltura | La fertilizzazione | CSC / pH / Conducibilità
Area professionisti | Le schede coltura | La fertilizzazione | CSC / pH / Conducibilità
Le acque d’irrigazione e la fertilizzazione danno risultati diversi a seconda della reattività del substrato, caratterizzata dalla CSC (Capacità di Scambio Cationico) e dal potere fissatore.
Queste conseguenze si basano soprattutto sulla risultante del pH e della conducibilità nel substrato.
- La fertilizzazione deve essere determinata in rapporto alla «reattività» chimica del substrato.
- Un substrato si dice «reattivo» quando provoca un cambiamento nella soluzione del substrato stesso, ossia nella soluzione nella quale si alimentano le radici.
Grazie alla loro costituzione naturale, le sostanze organiche e le argille presentano una carica elettrica negativa, sono cioè degli anioni. I cationi, invece, sono molecole con una carica elettrica positiva.
Nel substrato, i cationi sono presenti sotto due forme:
Semplificando, l'adsorbimento è molto simile a ciò che succede tra due calamite:
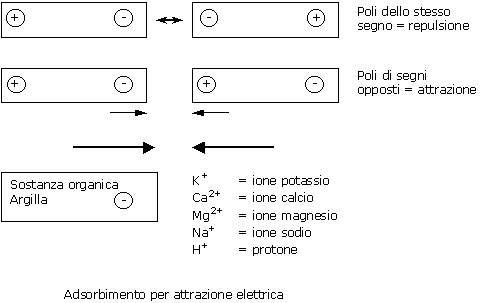
Le forze di attrazione tra i cationi adsorbiti e la superficie delle sostanze organiche o delle argille sono di bassa intensità. Questi legami, quindi, possono rompersi facilmente.
Grazie alla debolezza di queste energie di legame, esistono scambi cationici permanenti tra la soluzione del substrato e i punti di adsorbimento del substrato.
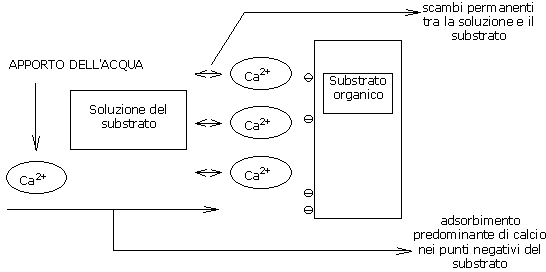
Conseguenze:
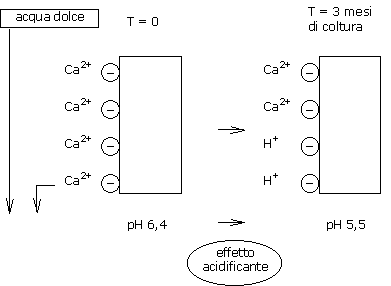
Un apporto di ioni calcio nella soluzione del substrato provoca un adsorbimento del calcio su questo stesso substrato se rimangono disponibili dei punti di fissazione.
Su un substrato a pH 5,5, la C.S.C. del substrato non è completamente satura di calcio.
Gli ioni calcio dell'acqua, quindi, vengono adsorbiti nei punti negativi disponibili del substrato, fino a SATURARE tutti i punti.
Si ottiene così il punto di saturazione della CSC.
La CSC è indubbiamente satura di calcio, ma il pH è stabile?
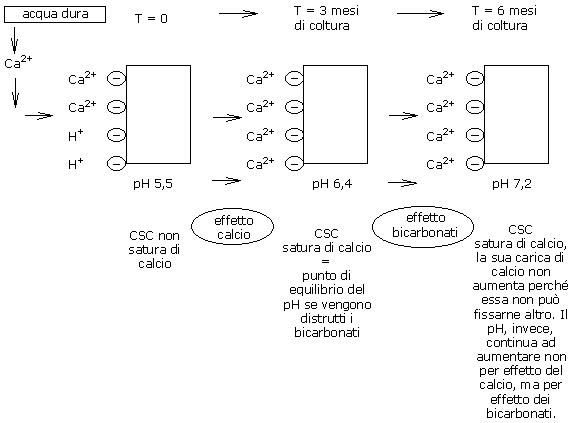
In caso di utilizzo di un'acqua dura in un substrato «reattivo», il calcio partecipa quindi alla stabilizzazione del pH della CSC.
Se i bicarbonati sono distrutti, la CSC rimane permanentemente satura di ioni di calcio e ciò consente una buona stabilizzazione del pH del substrato.
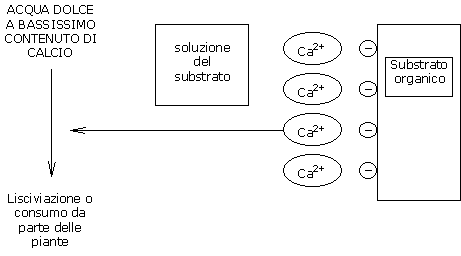
Conseguenze:
Il calcio fissato sulla CSC dei substrati organici è RESTITUITO alla soluzione del substrato, in modo tale da mantenere sempre un equilibrio identico tra la carica di calcio in soluzione e la carica di calcio nel substrato.
Gli ioni calcio persi sulla CSC sono sostituiti da ioni H+ (protoni).
Questi ioni H+ sono acidificanti e provocano un abbassamento del pH.
Si noti che una torba nera di altissima qualità ha un potere tampone almeno 3 volte superiore a quello di una torba bionda.


Le carenze = un mito?
Si osservi che le quantità fissate sulla CSC sono 40 volte superiori a quelle in soluzione per il calcio e 17 volte superiori a quelle per il magnesio.
In altre parole, le carenze di calcio e di magnesio nei substrati con pH superiore a 5,5 così come nei substrati a basso potere tampone, non sono realistiche, viste le grandi riserve di questi due elementi sulla CSC.
Le «carenze», o meglio le cattive assimilazioni di calcio e di magnesio in substrati organici classici, sono «indotte» e la causa è da ricercare prevalentemente nel binomio annaffiatura/substrato.
Esempio del nitrato di calcio apportato in un substrato a base di torba bionda (substrato con potere tampone):
Con un pH di 5,5, valore considerato basso, viene effettuato un apporto di nitrato di calcio per 15 giorni, per un totale di 6 volte nella dose di 1 grammo/litro.
Il tasso di saturazione di calcio della CSC si avvicina al 50%.

Questo esempio mostra il lato illusorio di un rapido aumento del pH con l'apporto di nitrato di calcio, a prescindere dal tipo di substrato organico.
Caso di un substrato con un pH iniziale pari a 5,5, ossia il 50% di saturazione di calcio e il 25% di saturazione di magnesio.
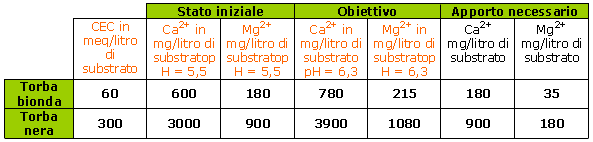
Caso di un'acqua dura che contiene 80 mg/litro di Ca2+ (4 meq/litro di Ca2+) e 20 mg/litro di Mg2+ (1,7 meq/litro di Mg2+):
Un'annaffiatura media di 100 ml/litro di substrato apporta: 8 mg di Ca2+ e 2 mg di Mg2+
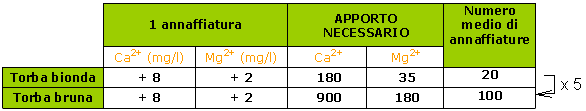
Se si utilizza un'acqua dura, il numero medio di annaffiature necessarie per far salire di un'unità il pH in un substrato «nero» è quattro o cinque volte superiore rispetto a quello per un substrato «biondo».
Per valori di pH inferiori a 4,5 e quindi per CSC con tasso di saturazione di Ca2+ e Mg2+ inferiore al 30%, il rischio di carenza è reale: comparsa di colorazione blu sulle azalee, blocco dello sviluppo di alcune piante da terra di brughiera.
Ad eccezione di questi casi estremi, nell'orticoltura in generale, si osservano più spesso carenze indotte, legate ad un cattivo abbinamento substrato/annaffiatura.
E' opportuno sapere che l'assimilazione di magnesio, in particolare, peggiora in caso di annaffiature lunghe e poco frequenti.
Anche un'insufficienza di aerazione a livello radicale provoca difficoltà di assimilazione del magnesio.
Per quanto riguarda il calcio, più la varietà è vigorosa, più questo elemento nutritivo è assimilato male dai ciclamini.
Le carenze di Ca o di Mg si correggono modificando le modalità di annaffiatura, riducendo l'igrometria all'interno della serra e limitando gli sbalzi di temperatura tra il giorno e la notte.
Il potassio è un catione con la più bassa percentuale di fissazione sulla CSC (con l'ammonio), vale a dire che le riserve di potassio rappresentano in media solo il 2,5% della CSC.
Inoltre, le quantità di potassio in soluzione e di potassio fissato sono quasi identiche.
In altre parole, il potassio è un elemento sensibile alla lisciviazione.
Si noti che il processo di lisciviazione del potassio in un substrato organico è in media due volte più lento di quello dell'azoto nitrico.
Inoltre, si osservi che lo ione ammonio ha all'incirca lo stesso effetto «ritardo» del potassio (per il quale si parla di riserve!).

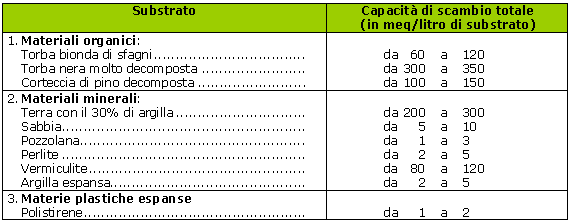
Il potere fissatore di un substrato corrisponde alla sua capacità di fissare gli anioni o gli oligoelementi.
Questo potere fissatore è legato alla presenza di sostanze «colloidali», quali sostanze organiche o argille, o alla presenza d'idrossidi di ferro o di allumina.
Alcuni terreni mostrano un buon potere fissatore del fosforo legato alla presenza di calcare.
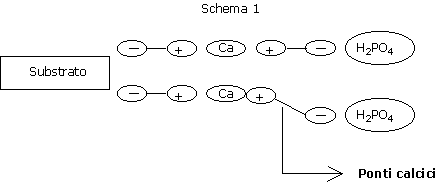
Nei substrati organici, i ponti calcici sono poco energetici.
Il potere fissatore del fosforo è da rapportare piuttosto alla presenza di torbe ricche di alluminio o di ferro.
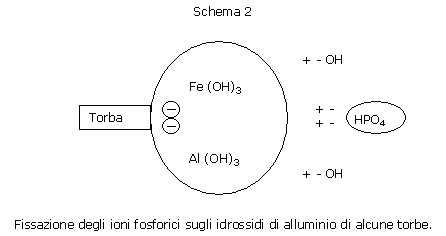
L’energia di fissazione dei fosfori sulle torbe può essere elevata e i fosfati possono essere non assimilabili dal ciclamino.
In questo caso è necessario saturare di fosfati tutti i punti alluminici, in modo che ogni apporto di fosfati tramite la fertilizzazione rimanga assimilabile e quindi solubile in acqua.
E' il ruolo della fertilizzazione di fondo.
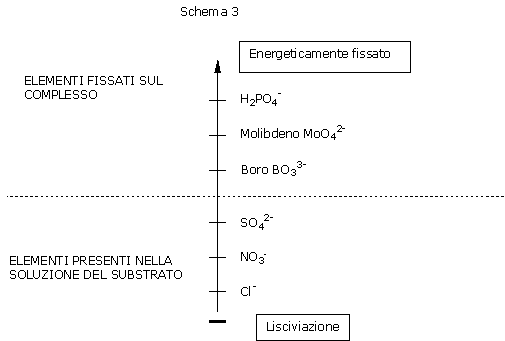
Cl-: i cloruri e l'azoto nitrico sono perfettamente lisciviabili.
SO42-: i solfati sono anch'essi lisciviabili, ma presentano la caratteristica di precipitare sotto forma di microcristalli di gesso (CaSO4, 2H2O). Questi microcristalli si accumulano e fanno diminuire per un certo tempo la concentrazione di solfati nel terreno colturale. Alla fine di un lungo ciclo di coltivazione, la precipitazione sotto forma di gesso rallenta e il tasso di solfati può aumentare se l'effetto «espulsione» non è sufficiente.
Si osservi, però, che i concimi solfatati presentano un maggior tenore salino rispetto ai loro equivalenti nitrati o fosfati, per cui si dovranno scegliere concimi poco carichi di solfato per limitare la salinità "immediata".
BO33-: il boro è adsorbito sul complesso organico e passa velocemente nella soluzione acquosa. La sua assimilabilità è peggiore in caso di forte alternanza tra annaffiature abbondanti e fasi di stress idrico. Questo fenomeno è tipico del periodo estivo.
MoO42-: il molibdeno è considerato come non lisciviabile, eccetto a pH acido.
Gli oligoelementi sopra citati sono presenti nei substrati organici essenzialmente in forma chelata: i chelati proteggono gli oligoelementi dalla lisciviazione.
Gli oligoelementi sono poco solubili in acqua.
L’assimilazione avviene essenzialmente per contatto tra la radice e il substrato. Se il contatto non è sufficiente, l'assimilazione non ha luogo e aumentano i rischi di carenza.
Va ricordata inoltre la fissazione molto forte del rame da parte dei materiali fermentescibili che provoca gravi malformazioni.
Tutte le reazioni biochimiche, a prescindere dal fatto che interessino l'uomo, l'animale o il vegetale, sono condizionate dall'ambiente nel quale si sviluppano.
Uno dei principali fattori che condizionano il buon andamento del ciclo vitale delle piante è il pH del terreno colturale.
Per quanto riguarda la linfa dei ciclamini, essa possiede un pH specifico alla specie.
Il pH è un elemento fondamentale per il controllo della nutrizione perché determina le condizioni di assimilazione degli elementi minerali.
Il pH misura la concentrazione di ioni idrogeno, H+, da cui il nome di Potenziale di Idrogeno.
Esso consente di misurare l'acidità o l'alcalinità del terreno colturale.
pH = - log [H3O+]

Il pH è molto sensibile al tasso di ossigenazione dell'estratto: più l'estratto è saturo di CO2 (anidride carbonica), più il valore del pH dell'acqua aumenta.
Più la salinità del substrato è elevata e più il valore del pH dell'acqua diminuisce.
Di conseguenza, la differenza tra il pH dell'acqua e il pH di KCl è minore. Infatti la presenza di sali, di concimi, che sono acidi deboli, o di basi deboli tampona il comportamento dell'idrogeno.
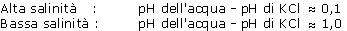
Il pH dell'acqua rimane il pH che riflette meglio le condizioni reali di pH presenti a livello delle radici.
Quindi sarà questa misurazione ad essere utilizzata dal produttore per impostare il programma di fertilizzazione.
I pH ottenuti con questo metodo sono sempre valori intermedi tra il pH di H2O e il pH di KCl.
Se pH di H2O - pH di KCl = 1.0,
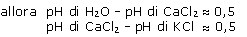
2.3 > PH KCl:
questo metodo, ispirato al comportamento dei terreni, consiste nel realizzare un estratto 1/2,5 con una soluzione KCl 1 N.
Questo pH indica lo stato di saturazione della CSC ed è abbastanza indipendente dalle condizioni del terreno colturale.
Esso consente quindi di seguire da vicino l'evoluzione della saturazione o della desaturazione di Ca e Mg del substrato.
Esempio:
Misurazione in un istante T del ciclo di coltivazione:
- substrato a medio potere tampone
15 giorni dopo, la conducibilità diminuisce a seguito di annaffiature appropriate:
Il pH di KCl esprime sempre un livello elevato di saturazione della CSC e il pH dell'acqua assume un valore più coerente, pari a 6,9. Tuttavia quest’ultimo rappresenta un valore a rischio per la coltivazione.
Un incorretto controllo del pH è un fattore che provoca regolarmente danni sui ciclamini.

L’intossicazione da alluminio, così come quella da manganese, va rapportata alla presenza di un pH acido dovuto all'uso di materiali instabili e fermentescibili.
I processi di fermentazione fanno aumentare la riduzione del manganese e dell'alluminio, forme che diventano solubili e potenzialmente tossiche. Il fenomeno, in seguito, è aggravato dall'asfissia radicale (mancanza di ossigeno legata alle fermentazioni).
Questo fenomeno d'intossicazione è frequente quando la coltura presenta una diminuzione del pH e un aumento della conducibilità.
La carenza di molibdeno in presenza di pH acido è più rara.
Nei terreni colturali a pH elevato, la scarsa disponibilità del fosforo è poco frequente e comporta un cattivo rendimento delle piante.
In caso di pH elevato, invece, ossia intorno a livelli compresi tra 7,1 e 7,2, la carenza di boro è reale e ben visibile.
Essa si manifesta spesso nel periodo estivo. Infatti, non solo il boro è poco disponibile a questi livelli di pH, ma inoltre il regime idrico globale è spesso insufficiente, e ciò inibisce l'assimilazione del boro, come accade spesso sui ciclamini.
In presenza di pH elevato, la carenza di ferro e di manganese è tipica delle specie sensibili alla clorosi ferrica, tra cui naturalmente il ciclamino che, essendo una specie bulbosa, assimila male questi due elementi.
Attenzione! Non è certo misurando il pH di un'acqua che se ne può determinare la «durezza» e quindi il suo effetto sul substrato.
Esempio: le acque pluviali
Le acque pluviali non contengono bicarbonato.
Di conseguenza, non presentano alcun potere tampone.
Queste acque assumono quindi il valore di pH dell'ambiente che le ospita.
Se sono conservate in un bacino, il loro pH si avvicina spesso a 8,0! .... In tal caso, infatti, il pH dipende dalla carica di gas solubilizzati nell'acqua (soprattutto CO2).
Queste stesse acque pluviali con pH 8,0, tolte dal bacino e apportate in un substrato a pH 5,8 assumono questo valore del pH e provocano progressivamente una decalcificazione del substrato e quindi un'acidificazione.
La «durezza» di un'acqua irrigua dipende dal tasso di bicarbonati HCO3- e non dal suo pH.
I bicarbonati sono una base forte (il contrario di un acido forte) perché provocano un forte aumento del pH.
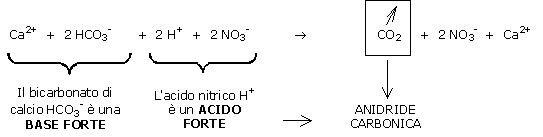
Si noti che i bicarbonati scompaiono sotto formA di anidride carbonica e che rimane in equilibrio una coppia acido debole/base debole NO3-/Ca2+ in soluzione.
Il pH, quindi, non può più aumentare.
Esso rimane stabile perché il calcio contenuto nell'acqua, sempre presente, compensa le perdite di Ca2+ sulla CSC.
Le acque dolci non contengono bicarbonati
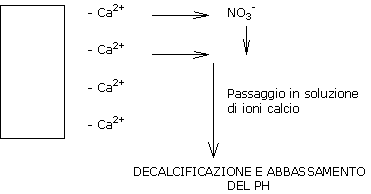
Si rende quindi necessaria una complementazione al nitrato di calcio per compensare le perdite di calcio e stabilizzare il pH.
La maggior parte delle caratteristiche acidificanti dei concimi è legata alla presenza di frazioni ammoniacali.
I concimi che contengono urea e alcuni concimi a lenta cessione (sconsigliati sul ciclamino) che contengono polimeri di urea sono acidificanti perché l'urea si trasforma in azoto ammoniacale per idrolisi.
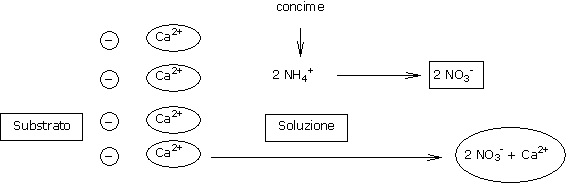
La trasformazione dell'azoto ammoniacale in azoto nitrico in soluzione acquosa provoca il passaggio in soluzione di un catione Ca2+ (o Mg2+) fissato sulla CSC per equilibrare elettricamente la soluzione.
Questo passaggio in soluzione degli ioni calcio e magnesio favorisce l'acidificazione progressiva del terreno colturale.
Alcuni concimi incorporano acidi forti con lo scopo di distruggere una frazione dei bicarbonati presenti.
pH e stabilità biologica dei materiali organici presenti
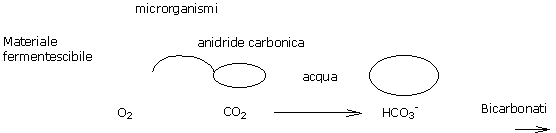
La fermentazione di materiali quali cortecce fresche, compost, ecc. provoca la produzione di anidride carbonica nella soluzione del substrato.
Una forte pressione dell'anidride carbonica nell'acqua favorisce la formazione di bicarbonati e quindi l'aumento del pH.
Se si considera, ad esempio, un ciclo di coltivazione di sei mesi, una miscela a base di cortecce con pH iniziale pari a 5,8 può raggiungere, al termine del ciclo, valori di pH superiori a 7,2.
La salinità, espressa in grammi per litro, indica la quantità di sali disciolti nella soluzione del substrato.
Essa si misura mediante la conducibilità elettrica.
Il principio di misurazione si basa sulla proprietà degli elettroliti (sostanze dissociate in ioni dopo la dissoluzione) di condurre più facilmente la corrente elettrica man mano che aumenta la loro concentrazione.
Esistono due modi per esprimere questi parametri:
1 - Conducibilità, espressa in millisiemens per centimetro (mS/cm).
Essa è proporzionale alla salinità.
2 - Resistività, espressa in ohm-cm.
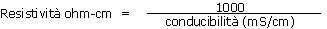
In Francia la misurazione della conducibilità è spesso effettuata su un estratto 1/1,5 di volume:
1 volume di substrato per 1,5 volumi di acqua demineralizzata.
La misurazione va effettuata dopo almeno 20 minuti di contatto (si consiglia la filtrazione).
L’effetto più immediato della salinità della soluzione del substrato è di creare una pressione osmotica tale che il ciclamino non è più in grado di assorbire l'acqua.
Si tratta della cosiddetta secchezza fisiologica.
Questo processo è utilizzato per controllare la vigoria della pianta.
La vigoria di una pianta bulbosa dipende principalmente dalla "regolarità" dei fattori di produzione. Più le annaffiature sono regolari e la conducibilità è costante, migliori sono la vigoria e l'equilibrio vegetativo.
Nel tipico ciclamino fiorito da vaso, la conducibilità sarà piuttosto bassa.
Nel mini-ciclamino e nei substrati ad alto contenuto di torba (quindi a basso coefficiente effettivo di salinità), la conducibilità presenterà valori elevati al fine di mantenere una pianta dall'aspetto compatto. La frequenza delle annaffiature su volumi ridotti di substrato favorisce, infatti, un equilibrio idrico che deve essere compensato da conducibilità più elevate.
La misurazione della conducibilità è utilizzata per determinare il livello nutritivo del substrato.
Esempio 1:
Estrazione di 1/1,5 vol. Misurazione della conducibilità e degli elementi nutritivi in un substrato a base di torba arricchito con PG Mix nella dose di 1 kg/m3

In questo esempio, la misurazione della conducibilità può sottovalutare la frazione azotata.
Effettivamente, l'azoto ammoniacale si nitrifica e la conducibilità aumenta schematicamente in maniera rilevante.
Esempio 2:
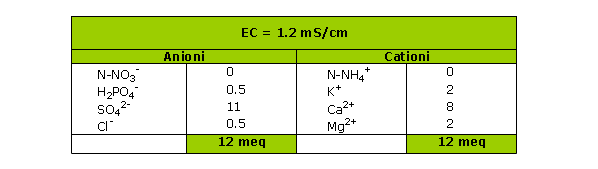
Il livello di conducibilità misurato indica a priori un livello nutritivo appropriato, mentre la conducibilità è legata solo ad una carica elevata di solfati (i materiali organici producono solfati al momento della maturazione).
E' quindi preferibile, su questo estratto, effettuare una misurazione dell'azoto, ricorrendo, ad esempio, a test veloci.
Attenzione all'eccesso di sale che rende le piante sensibili alle malattie, provoca l'alterazione dei peli assorbenti nonché un cattivo passaggio del calcio e, in particolare, del magnesio.
2565, rue de Montourey
83600 Fréjus - France
Telefono internazionale : +33 (0)4 94 19 73 04
Centralino : + 33 (0)4 94 19 73 00
Fax : +33 (0)4 94 19 73 19

